 El cáncer de mama es el cáncer más frecuente entre las mujeres, un 28% de todos los cánceres femeninos. En España se diagnostican cada año unos 28.000 nuevos cánceres de mama, unos 500 de los cuales se detectan en las Illes Balears.
El cáncer de mama es el cáncer más frecuente entre las mujeres, un 28% de todos los cánceres femeninos. En España se diagnostican cada año unos 28.000 nuevos cánceres de mama, unos 500 de los cuales se detectan en las Illes Balears.
El cáncer de mama presenta un 85% de supervivencia, elevada gracias a las mejoras diagnósticas y terapéuticas, y a la detección en fases tempranas.
Los procedimientos de auto palpación del seno en los que se entrena a las mujeres para la detección de nódulos extraños son eficaces para la prevención si se conocen los procedimientos adecuados. Sin embargo, las revisiones mediante mamografía que se realizan a través de campañas que alcanzan a todas las mujeres a partir de determinada edad son mucho más certeras.
El Programa de Detección Precoz de Cáncer de Mama de las Illes Balears, desarrollado por la Dirección General de Salud Pública y Participación y el Servicio de Salud, cita cada 2 años a las mujeres con edades comprendidas entre los 50 y 69 años para hacerse una mamografía preventiva gratuita, así como todas las actuaciones que sean necesarias para llegar al diagnóstico.
En 2016 se citó a 40.783 mujeres, de las que participó el 71,59%, (29.196). De éstas, 1.259 precisaron exploraciones complementarias, entre las que se diagnosticaron 149 casos de cáncer de mama. En los primeros nueve meses de 2017 se ha citado a 26.249 mujeres en Mallorca; 2.651, en Menorca, y 4.493, en Eivissa y Formentera, participando 16.797, 2.017 y 2.982, respectivamente.
Entre enero y septiembre de este año las mamografías realizadas por prescripción médica fue de 13.514. Por hospitales, se han realizados 5.005 mamografías en Son Espases; 3.406, en Son Llàtzer; 1.424, en el Hospital de Manacor; 1.103, en el Hospital de Comarcal de Inca; 964, en el Hospital Mateu Orfila de Menorca; 1.530, en Can Misses, y 82, en el Hospital de Formentera.
PREVENCIÓN SECUNDARIA
El Programa de Detección Precoz de Cáncer de Mama es una actividad de prevención secundaria que permite el diagnóstico temprano de la enfermedad, facilita la supervivencia y admite tratamientos menos agresivos, dado que el tumor requiere menores acciones quirúrgicas y complementarias (radioterapia y/o quimioterapia) cuanto más pequeño es cuando se detecta.
El personal técnico del Programa colabora con el Grupo de Epidemiología Ambiental y Cáncer del Centro Nacional de Epidemiología del Instituto Carlos III en una línea de investigación para cuantificar el riesgo de desarrollar cáncer de mama asociado a la densidad mamográfica, uno de los programas de investigación punteros, actualmente, en este ámbito de la ciencia médica.
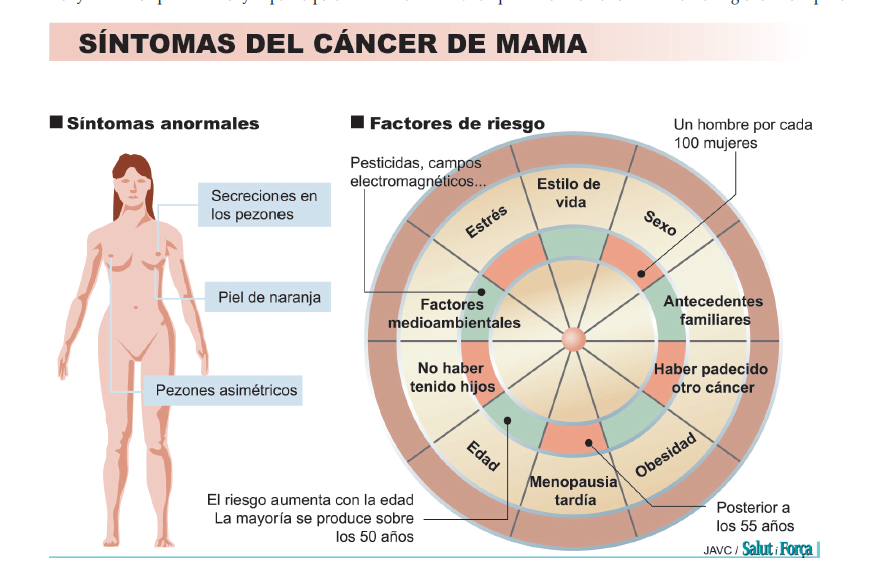
Ante el desconocimiento de causas directas para desarrollar este cáncer y a la hora de hacer una prevención activa sí que cabe recordar el efecto protector de la dieta mediterránea sobre el cáncer de mama. Las mujeres deben conocer la importancia de evitar el sobrepeso y la obesidad, restringir el consumo de alcohol, seguir una dieta mediterránea y realizar actividad física regular.
Si la mujer tiene entre 50 y 69 años y no ha recibido la invitación del Programa puede ponerse en contacto llamando al 971 21 21 10 o a través de la web
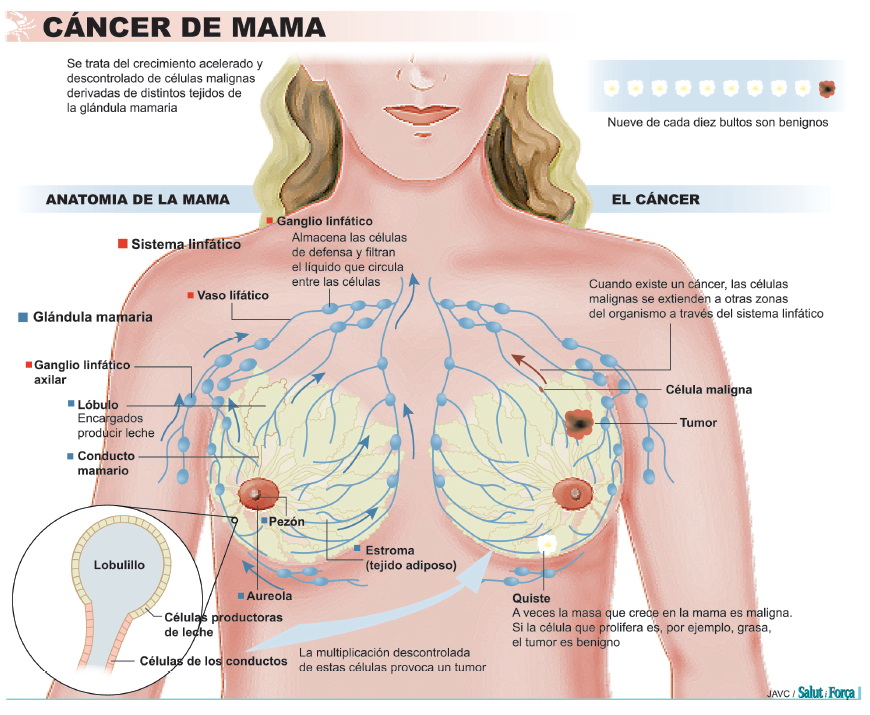
Los especialistas explican en la página web de la AECC (www.aecc.es) que el cáncer de mama es el tumor maligno que se origina en el tejido de la glándula mamaria: “Cuando las células tumorales proceden del tejido glandular de la mama y tienen capacidad de invadir los tejidos sanos de alrededor y de alcanzar órganos alejados e implantarse en ellos, hablamos de cáncer de mama.” CRECIMIENTO TUMORAL Este tumor puede crecer de tres maneras: con un crecimiento local crece por invasión directa, infiltrando otras estructuras vecinas como la pared torácica (músculos y huesos) y la piel. Por una diseminación linfática: la red de vasos linfáticos que posee la mama permite que el drenaje de la linfa se efectúe a varios grupos ganglionares (de ahí la importancia del ‘ganglio centinela’).
Los ganglios situados en la axila (axilares) son los más frecuentemente afectados, seguidos de los situados en la arteria mamaria interna (zona central del tórax) y los ganglios supraclaviculares (encima de la clavícula). En tercer lugar puede producirse una diseminación hematógena: se realiza a través de los vasos sanguíneos preferentemente hacia los huesos, pulmón, hígado y piel.
Los síntomas más frecuentes por los que la mujer acude al médico son la aparición de un nódulo en la mama que previamente no existía; dolor en la mama a la palpación; cambio de tamaño de alguna de las mamas; irregularidades en el contorno; menor movilidad de una de las mamas al levantar los brazos, explican los especialistas de la AECC que también añaden: La alteración en la piel de la mama como: úlceras, cambios de color y aparición de lo que se denomina piel de naranja (por su aspecto similar a la piel de dicha fruta); cambios en el pezón, como puede ser la retracción del mismo (hundimiento); aparición de un nódulo en la axila. Existen otros síntomas como son el cansancio o el dolor óseo localizado, fases más avanzadas de la enfermedad.
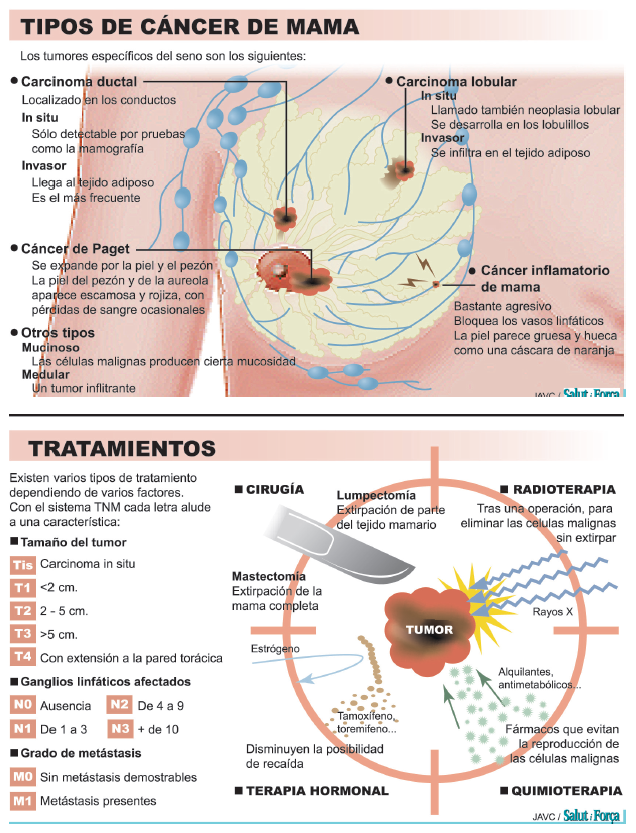
Los expertos de la AECC explican que se utilizan diversas definiciones respecto al tratamiento: el tratamiento local se refiere al tratamiento dirigido al tumor en su lugar de origen o en alguna localización determinada.
La cirugía y la radioterapia son ejemplos de ello. El tratamiento sistémico afecta a todo el organismo. La quimioterapia y la hormonoterapia son tratamientos sistémicos.
TRATAMIENTO ADYUVANTE
Se denomina tratamiento adyuvante al tratamiento sistémico y/o local administrado tras el primer tratamiento. El objetivo es profiláctico, tanto a nivel sistémico como local, es decir, pretende reducir el riesgo de recidiva del cáncer de mama.
El tratamiento neoadyuvante es administrar un tratamiento sistémico antes de uno local para reducir el tamaño del tumor antes de la cirugía.
El tipo de cirugía dependerá del tamaño, localización y extensión del tumor. Cuando se extirpa sólo el tumor se llama tumorectomía. Cuando lo que se extirpa es el cuadrante donde se localiza el tumor, es una cuadrantectomía. Cuando se extirpa la mama entera, se denomina mastectomía. Mastectomía radical modificada: Es la más utilizada. En ella se extirpa la mama.
La mastectomía radical (también mastectomía tipo Halsted) consiste en la extirpación de la mama, de los músculos pectorales y de los ganglios axilares. Esta técnica se utilizaba mucho en el pasado, pero no en el momento actual.
Los efectos secundarios de alteración de la imagen corporal, alteraciones en la movilidad del miembro superior, edema, etcétera son muy frecuentes.
Existe la posibilidad –siempre según explican los expertos de la AECC en su página web –de que sea necesario un tratamiento con radioterapia tras la mastectomía, aunque esto ocurre en un porcentaje bajo de pacientes.
Sea cual sea el tipo de intervención, debe realizarse la valoración del estado de los ganglios axilares para detectar si se ha producido una diseminación por esa vía.
Dependiendo del estado clínico de la axila se realizará una biopsia selectiva del ganglio centinela o una linfadenectomía.
El paquete ganglionar axilar es grande. Dependiendo de la accesibilidad se suelen extirpar entre 10 y 40 ganglios linfáticos. Actualmente solo se realiza linfadenectomía cuando existe una sospecha clínica fundada o se ha confirmado infiltración tumoral de los ganglios.
GANGLIO CENTINELA
El ganglio centinela (GC) es una técnica, cada vez más empleada, cuyo objetivo es identificar el ganglio axilar sobre el que, en primer lugar, drena la mama. Si este ganglio está afectado por el mismo, en general es necesario realizar un estudio del resto de los ganglios de la axila. Si no está afectado no se puede realizar linfadenectomía, explican los expertos de la AECC, y añaden: De esta manera, en los casos en que no se realice vaciamiento axilar, el riesgo de efectos secundarios derivados de la extracción de ganglios linfáticos es mínimo. La base de esta exploración es la siguiente: Si el GC es negativo (sin invasión tumoral) el resto de la cadena también lo será, con las implicaciones pronósticas y terapéuticas que ello conlleva.
Si el GC es positivo, el resto de la cadena puede o no serlo, pero se debe proceder a la linfadenectomía de la zona y a las actuaciones terapéuticas adicionales que procedan. El índice de concordancia entre el estado real de la axila y la del ganglio centinela se sitúa en torno al 97%. Preocupa la existencia de falsos negativos cuya cifra en los grupos con experiencia es inferior al 5%.
Para efectuar el estudio del GC, se debe encontrar un trazador que simule el comportamiento que tendría una célula maligna desprendida del tumor principal. La sustancia de uso más frecuente es el nanocoloide de albúmina marcado con 99mTc. Con el fin de aumentar la precisión en la localización de este ganglio, se comenzaron a utilizar métodos de tinción mediante colorantes.
Con posterioridad, se introdujo la localización del ganglio centinela inoculando radioisótopos, inmediatamente antes de la intervención, en las proximidades del tumor y utilizando, intraoperatoriamente, una sonda de detección de rayos gamma. El marcado isotópico ganglionar se efectúa más frecuentemente con coloide de albúmina (nanocoloide marcado con 99mTc).
LOCALIZACIÓN DEL GCC
La localización del ganglio/s centinela/s se realiza mediante la visualización de los conductos y ganglio/os linfáticos coloreados y con la utilización de una sonda de detección de radiaciones gamma.
Esto permite más facilidad al cirujano y más precisión, ya que utilizando ambas técnicas, la probabilidad de encontrar el ganglio centinela aumenta.
La revista ‘Clinical Traslacional Oncology’, ha publicado recientemente un artículo del Servicio de Oncología del Hospital Juan Ramón Jiménez y la Universidad de Huelva con los resultados de un estudio de investigación en el cual se ha identificado un nuevo marcador sanguíneo que podría ser clave para diagnosticar el cáncer de mama en las fases precoces de la enfermedad.
Según ha informado la Junta en una nota de prensa, el estudio ha sido codirigido por el jefe de la Unidad de Oncología del Hospital Juan Ramón Jiménez, Juan Bayo, y el doctor en Biología Celular de la Universidad de Huelva, Francisco Navarro, con la participación del facultativo del Servicio de Análisis Clínicos del centro sanitario, Miguel Ángel Castaño.
El objetivo de esta investigación ha sido la búsqueda de un marcador sanguíneo que se elevara en las fases precoces del cáncer de mama y sirviera como complemento al programa de detección precoz. Para ello, se ha estudiado la utilidad de un grupo de los marcadores tumorales que se vienen aplicando de manera habitual, así como otros marcadores experimentales menos conocidos.
En este estudio han participado un total de 126 mujeres. De ellas, 63 eran pacientes con cáncer de mama precoz (microscópicos o de pequeño tamaño) sin afectación axilar, de manera previa a su intervención quirúrgica; y otras 63 eran mujeres sanas. A todas ellas se les realizó una analítica de sangre para estudiar los valores que tenían en un total de diez marcadores.
NUEVO MARCADOR
En el análisis de los resultados se encontró la existencia de un marcador muy sensible que se elevó en el grupo de pacientes afectadas de cáncer.
Este marcador experimental, denominado 8-OHdG, es un derivado del nucleótido guanosina, producido cuando esta molécula es sometida al proceso químico de estrés oxidativo presente en el inicio de la enfermedad a nivel celular.
Es la primera vez que se estudia este marcador en diagnóstico precoz del cáncer de mama. Otras investigaciones realizadas hasta ahora se centraban en fases más avanzadas de la enfermedad. Estos resultados abren un nuevo campo de estudios a nivel internacional al ser un factor de riesgo independiente de la enfermedad, según han explicado fuentes del Servicio Andaluz de Salud.
Las personas con niveles más elevados de este marcador tienen un 1,5 más riesgo de padecer un cáncer de mama que aquellas que tienen los valores más bajos. Además, en esta misma investigación se ha mejorado aún más la capacidad predictiva del cáncer de mama aportada por este marcador en solitario, con el diseño de un modelo matemático compuesto por otros cuatro marcadores.
Este modelo eleva las posibilidades de la detección hasta un potencial diagnóstico del 92%, siendo capaz de predecir la existencia de cáncer de mama en un alto porcentaje de las pacientes en la fase precoz, con una seguridad muy elevada.
Con una simple extracción sanguínea podría conocerse si una paciente con una mamografía sospechosa tiene o no cáncer de mama.
Un resultado analítico que serviría para decidir si procede realizar una biopsia quirúrgica confirmatoria del diagnóstico o simplemente un seguimiento radiológico periódico de manera preventiva. Por otro lado, en el análisis epidemiológico efectuado a todas las mujeres estudiadas, sanas o con enfermedad, resultaron variables de riesgo significativas para la enfermedad.
VARIABLES E INVESTIGACIÓN
Estas variables son edad, menopausia, paro, elevado de índice de masa corporal (IMC) y niveles bajos de vitamina D, coincidiendo con los grandes estudios epidemiológicos. En la actualidad se está diseñando una investigación a mayor escala que permita definir más cuáles son los valores de este marcador en mujeres sanas y enfermas y que permitiría su utilización en la práctica clínica.
En esta segunda fase confirmatoria se prevé medir el estrés oxidativo y, en concreto, el marcador 8-OHdG en pacientes con cáncer de mama en las distintas situaciones clínicas de la enfermedad, como son, el diagnóstico precoz, el inicio del tratamiento, el período de seguimiento o la enfermedad avanzada. Asimismo, puede ser el inicio de nuevos estudios en otras patologías.
Sería el caso de otras afecciones oncológicas que compartan historia natural y condiciones clínicas que permitan un diagnóstico precoz como son el cáncer de colon o el cáncer de próstata, también con una elevada incidencia y que pueden beneficiarse en un futuro de las posibilidades que han sido descubiertas por los investigadores de este nuevo marcador.
Otra novedad es el el estudio liderado por Robert E. Coleman, de la Universidad de Sheffield, y el investigador ICREA del Instituto de Investigación Biomédica (IRB Barcelona), Roger Gomis, publicado en Lancet Oncology, descubre la amplificación del gen MAF como una aproximación que permite estratificar a los pacientes de cáncer de mama, informa la Agencia SINC.
Estas pacientes que se beneficiarían del uso de ácido zoledrónico en un contexto adyuvante (pacientes negativos para MAF), de aquellos que les sería perjudicial (positivos para MAF y que no estén en postmenopausia). Las metástasis óseas son el único tipo del que se disponen de tratamientos que, aunque sin curarlas, las mantiene controladas, señalan los expertos.
FÁRMACOS AMBIVALENTES
Ahora bien, advierten, la terapia solo se administra una vez la metástasis se manifiesta y suele ser demasiado tarde.
Estudios preliminares indican que los mismos fármacos para tratarlas serían igualmente válidos para evitarlas, por ello identificar los pacientes que podrían beneficiarse de los fármacos es clave. Es aquí donde este descubrimiento puede ser de gran utilidad.
“Evitaría el tratamiento de pacientes que no se beneficiarían o que podrían salir perjudicados», sugiere Gomis, jefe del laboratorio Control de Crecimiento y Metástasis. El tratamiento preventivo contra las metástasis al hueso puede tener efectos secundarios indeseables y un coste elevado, por tanto, no se puede administrar masivamente; podría ser perjudicial para el 4% de los pacientes.
«Para implementar un test diagnóstico de acompañamiento a un tratamiento, primero hay que saber qué pacientes pueden beneficiarse de él y cuáles no. Nuestro descubrimiento ofrece un modo de distinguirlos, cuando antes no era posible», confirma Gomis, según se refleja en un reciente artículo publicado por la Agencia SINC al respecto de este nuevo avance.
Este estudio se ha centrado en la asociación entre el beneficio del tratamiento, la amplificación del gen MAF y el resultado final. En pacientes MAF-negativos, la inclusión de ácido zoledrónico en el contexto adyuvante se asocia con mejores resultados, independientemente del estado de la menopausia.
Pero el estudio advierte de otras posibilidades: En pacientes con MAF-positivo no postmenopáusicas en el inicio del tratamiento, observan un aumento de resultados adversos y mortalidad. La evaluación en función de MAF tiene el potencial de convertirse en un enfoque objetivo para seleccionar pacientes con cáncer de mama al que administrar un tratamiento adyuvante con bisfosfonato (es decir, ácido zoledrónico).













