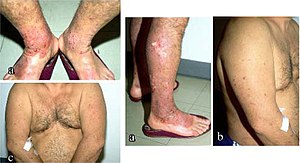
Imagen del prurigo nodular no controlado de Wikipedia.
Los resultados positivos del ensayo en fase III PRIME para evaluar el dupilumap, de Sanifi, en adultos con prurigo nodular no controlado han sido recientemente presentados en el Congreso de la Academia Europea de Dermatología y Venereología (European Academy of Dermatology and Venereology, EADV) de 2022.
Estos datos de uno de los dos ensayos pivotales en prurigo nodular muestran que el medicamento reduce significativamente el picor y las lesiones cutáneas a las 24 semanas. En total, se presentan 22 resúmenes científicos en la EADV que analizan dupilumab en dermatitis atópica en pacientes de tan solo 6 meses de edad y su posible uso en urticaria crónica espontánea y en penfigoide ampolloso, además de prurigo nodular.
El Dr. Gil Yosipovitch, profesor de Dermatología de la Facultad de Medicina Miller, Universidad de Miami, director del Miami Itch Center e investigador principal del ensayo, dice que «estos resultados positivos del segundo de dos ensayos en fase III con dupilumab en prurigo nodular confirman que la inhibición de la IL-4 e IL-13 puede reducir significativamente el picor incesante y las lesiones cutáneas graves extensas que a menudo afectan a la calidad de vida del paciente. En mi consulta, aliviar el picor y aclarar la piel de lesiones suelen ser las principales prioridades para mis pacientes en una variedad de enfermedades crónicas de la piel. Estos datos demuestran que dupilumab tiene el potencial de abordar y tratar estos síntomas debilitantes en otra enfermedad cutánea crónica con inflamación subyacente de tipo 2».
Los datos de última hora presentados en la EADV 2022 proceden del ensayo PRIME en fase III aleatorizado y con un brazo control con placebo, que cumplió con los objetivos principal y secundarios clave. A las 24 semanas, entre los pacientes tratados con Dupixent en el ensayo:
• Más del triple (60 %) experimentaron una reducción clínicamente significativa del picor desde el inicio, el objetivo principal del ensayo, en comparación con los pacientes tratados con placebo (18 %; p < 0,0001).
• Casi el triple (48 %) lograron tener una piel aclarada o casi aclarada de lesiones, un objetivo secundario del ensayo, en comparación con los pacientes tratados con placebo (18 %; p = 0,0004).
Los resultados de seguridad fueron generalmente coherentes con el perfil de seguridad conocido del medicamento en su indicación dermatológica aprobada. Para el periodo de tratamiento de 24 semanas, las tasas globales de acontecimientos adversos (AA) fueron del 71 % para el tratamiento y del 63 % para placebo. Los AA observados con mayor frecuencia con el medicamento estudiado (≥5 %) fueron nasofaringitis (5 % con dupilumab, 4 % con placebo) y 1/5 cefalea (5 % con el fármaco, 5 % con placebo). La tasa de interrupción del tratamiento debido a AA antes de la semana 24 fue del 0 % con dupilumab en comparación con el 4 % con placebo. Se observó una tasa numéricamente menor de infecciones cutáneas con Dupixent (4 % con el fármaco, 9 % con placebo).
Los resultados de este y de un ensayo en fase III anterior, PRIME2, constituirán la base de las solicitudes de registro este año de dupilumab en todo el mundo para prurigo nodular. La Comisión Europea y la FDA (la Administración de Alimentos y Medicamentos de los EE. UU.) ya están revisando las solicitudes de registro reglamentarias, y la FDA concedió la revisión prioritaria en mayo de 2022 y se esperan novedades hacia el 30 de septiembre de 2022.
Los posibles usos de dupilumab en prurigo nodular, urticaria crónica espontánea y penfigoide ampolloso están actualmente en desarrollo clínico, y ninguna autoridad reguladora ha evaluado completamente su seguridad y eficacia.
Los pacientes con prurigo nodular experimentan picor intenso y persistente, con lesiones cutáneas gruesas (denominadas nódulos) que pueden cubrir la mayor parte del cuerpo. El prurigo nodular suele describirse como doloroso con ardor, escozor y hormigueo en la piel.
El impacto del prurigo nodular no controlado en la calidad de vida es uno de los más altos entre las enfermedades inflamatorias de la piel debido al picor extremo y comparable a otras enfermedades crónicas debilitantes que pueden afectar negativamente a la salud mental, las actividades de la vida diaria y las interacciones sociales. Con frecuencia, se recetan corticosteroides tópicos de alta potencia, pero se asocian con riesgos de seguridad si se utilizan a largo plazo.
PRIME, parte del programa clínico LIBERTY-PN PRIME, es un ensayo en fase III, aleatorizado, doble ciego y con un brazo de control con placebo que evaluó la eficacia y la seguridad de dupilumab en 151 adultos con prurigo nodular no controlado. Estos incluían a pacientes que no estaban controlados adecuadamente con tratamientos tópicos o para los que esos tratamientos no eran aconsejables.
Durante el periodo de tratamiento de 24 semanas, los pacientes recibieron Dupixent o placebo cada dos semanas con o sin tratamientos tópicos (se continuó con corticosteroides tópicos en dosis bajas o medias, o inhibidores tópicos de la calcineurina si los pacientes estaban utilizando estos tratamientos en la aleatorización).
El principal objetivo del ensayo evaluó la proporción de pacientes con mejoría clínicamente significativa del picor a las 24 semanas (medida por una reducción ≥4 puntos en la Escala de valoración numérica del peor picor [Worst-Itch Numeric Rating Scale, WI-NRS] de 0 a 10).
Un objetivo secundario fue la proporción de pacientes con piel aclarada o casi aclarada de lesiones a las 24 semanas (medida mediante una puntuación de 0 o 1 en la escala de 0 a 4 de la evaluación global del investigador de la fase de PN [IGA PN-S]). Dupixent es un anticuerpo monoclonal totalmente humano que inhibe la señalización de las vías de la interleucina-4 (IL-4) e interleucina-13 (IL-13).
No es un inmunosupresor. El programa de desarrollo del medicamento ha demostrado un beneficio clínico significativo y una disminución de la inflamación de tipo 2 en ensayos en fase III, lo que establece que la IL-4 y la IL-13 son factores clave y centrales de la inflamación de tipo 2 que desempeña un papel importante en múltiples enfermedades relacionadas y, a menudo, comórbidas.
Estas enfermedades incluyen indicaciones aprobadas de dupilumab para asma, dermatitis atópica, rinosinusitis crónica con poliposis nasal (RSCcPN) y esofagitis eosinofílica (EEo), así como enfermedades en investigación como el prurigo nodular.
Dupilumab ha recibido aprobaciones regulatorias en todo el mundo para su uso en determinados pacientes con dermatitis atópica, asma, RSCcPN o EEo en diferentes poblaciones de edad. Está aprobado actualmente para estas indicaciones en EE. UU. y para una o más de estas indicaciones en más de 60 países, incluidos la Unión Europea y Japón. Más de 500.000 pacientes se han tratado con este medicamento en todo el mundo.
En España, está comercializado para dermatitis atópica grave en adultos, adolescentes y niños desde los 6 años; así como para asma grave con inflamación tipo 2 en adultos y adolescentes de 12 o más años de edad.
Dupilumab se está desarrollando por Sanofi y Regeneron de manera conjunta bajo un acuerdo de colaboración global. Hasta la fecha, se ha estudiado en más de 10.000 pacientes en 60 ensayos clínicos en diversas enfermedades crónicas basadas en parte en inflamación de tipo 2.
Además de las indicaciones aprobadas actualmente, Sanofi y Regeneron están estudiando dupilumab en una amplia gama de enfermedades derivadas de la inflamación de tipo 2 u otros procesos alérgicos, incluyendo prurigo nodular, esofagitis eosinofílica pediátrica, dermatitis atópica de manos y pies, urticaria crónica espontánea, urticaria inducible por frío, prurito crónico de origen desconocido, enfermedad pulmonar obstructiva crónica con evidencia de inflamación de tipo 2, rinosinusitis crónica sin poliposis nasal, rinosinusitis fúngica alérgica, aspergilosis broncopulmonar alérgica y el penfigoide bulloso.
Estos usos potenciales de dupilumab están actualmente en fase de investigación clínica, y la seguridad y la eficacia en estas afecciones no han sido plenamente evaluadas por ninguna autoridad reguladora. Estos posibles usos están en investigación actualmente y ninguna autoridad sanitaria ha evaluado plenamente su seguridad y la eficacia en estas afecciones.