Los resultados de un análisis agrupado preespecificado de los ensayos pivotales de fase 3 MELODY y de fase 2b de nirsevimab demostraron una eficacia (reducción del riesgo relativo frente a placebo) del 79,5% (IC del 95%: 65,9 a 87,7; p<0,0001) frente a las ITRI atendidas médicamente, como la bronquiolitis o la neumonía, causadas por el VRS en lactantes nacidos a término o prematuros que se exponían a su primera temporada de VRS. (1)
En un análisis post-hoc adicional, las muestras de sangre tomadas de los lactantes a los que se les administró nirsevimab mostraron, aproximadamente, anticuerpos neutralizantes frente al VRS 50 veces más altos que los de la línea base, 151 días después de la dosis. Los niveles de anticuerpos neutralizantes frente al VRS se mantuvieron 19 veces más altos que en los sujetos con placebo, sin infección conocida por el VRS hasta el día 361, lo que sugiere que la protección puede extenderse más allá del día 151. (2)
El perfil de seguridad de los grupos de nirsevimab y de placebo, tal y como se comunicó en ensayos anteriores, sigue siendo similar. 3-6 Estos resultados contribuyen al creciente conjunto de evidencias que sugieren que nirsevimab puede proteger a todos los lactantes durante su primera temporada de VRS con una sola dosis. (1-7)
El Prof. Federico Martinón-Torres, coordinador y Jefe de Servicio de Pediatría del Hospital Clínico Universitario de Santiago, miembro del CIBER de Enfermedades Respiratorias del ISCIII (CIBERES) e investigador en virus respiratorio sincitial del Instituto de Investigación Sanitaria de Santiago, ha declarado que “el VRS es el auténtico COVID de los lactantes, un virus que cada año colapsa la atención pediátrica en primaria y llena nuestros hospitales con lactantes con insuficiencia respiratoria, y frente al cual no tenemos ninguna herramienta preventiva de aplicación general. Con nirsevimab tendríamos por primera vez la oportunidad de cambiar el paradigma de atención del VRS, y potencialmente transformar la prevención de una infección que supone la primera causa de hospitalización en el lactante sano.”
Jean-François Toussaint, director global de Investigación y Desarrollo de Vacunas, Sanofi, ha dicho que «estos nuevos análisis son muy consistentes y confirman los sólidos resultados observados en todos los estudios de fase 2 y fase 3 que evaluaron nirsevimab en diversas poblaciones pediátricas. Nos sentimos orgullosos de los avances realizados para desarrollar una posible solución que aborde esta necesidad largamente insatisfecha para todos los lactantes.»
Mene Pangalos, vicepresidente ejecutivo de R+D Biofarmacéutica de AstraZeneca, AstraZeneca, ha manifestado que «cada año, el VRS provoca epidemias estacionales de infecciones del tracto respiratorio inferior en los lactantes. Estos análisis se suman al convincente conjunto de evidencias de nirsevimab como primera posible inmunización preventiva de dosis única para todos los lactantes, abordando una clara necesidad no cubierta en el panorama preventivo del VRS.»
Los datos se han presentado en la 40ª reunión anual de la Sociedad Europea de Enfermedades Infecciosas Pediátricas (ESPID), que se celebra del 9 al 13 de mayo en Atenas (Grecia). Nirsevimab está siendo desarrollado por Sanofi y AstraZeneca. El virus respiratorio sincitial (VRS) es la principal causa de infecciones de vías respiratorias inferiores como la bronquiolitis y neumonía en niños menores de 1 año8 y se estima que el 90% de los niños habrá sido infectado por VRS durante los dos primeros años de vida (9), incluso sufriendo más de un episodio.
En España, el VRS provoca el 80% de las bronquiolitis (9), una infección pulmonar común en bebés y niños pequeños que causa inflamación y congestión en los bronquiolos del pulmón. La evolución de la enfermedad causada por el VRS es impredecible, la mayoría de los casos son leves y suelen solucionarse tras pocas semanas sin tratamiento, pero en otros puede agravarse la dificultad respiratoria y requerir hospitalización (10-11).
El riesgo de padecer una infección con complicaciones severas se extiende a todos los niños; en nuestro país al menos el 1 de cada 10 ingresos hospitalarios en niños menores de 5 años se deben al VRS y el 95% de los casos en menores de 2 años ocurren en niños previamente sanos (12), 3 de cada 4 ingresos en la UCIP ocurren en niños sin factores de vulnerabilidad (9).
A nivel de carga asistencial hospitalaria ambulatoria, se estima que por cada episodio de VRS en menores de 12 meses se realizan hasta 9 visitas a atención primaria y 2 al servicio de urgencias de media13. En el caso de las hospitalizaciones el tiempo medio de estancia en el hospital de un ingreso por VRS es de 5,7 días y el coste estimado por paciente asciende a 2.440€ (12). Estas cifras ponen en evidencia la relevancia de la carga asistencial que supone el VRS para el sistema sanitario español.
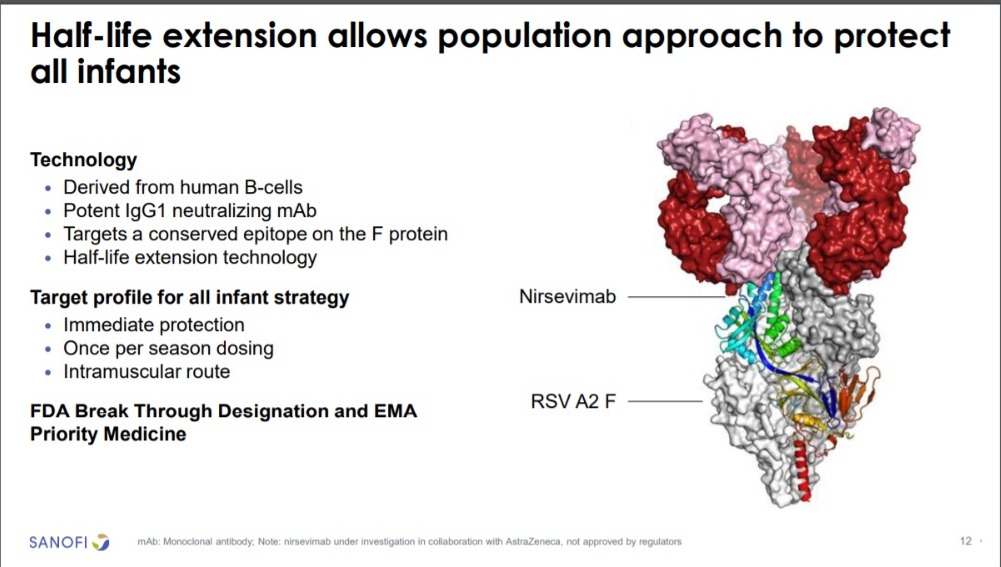
Nirsevimab es un anticuerpo monoclonal de acción prolongada en investigación desarrollado para proteger a todos los lactantes durante su primera temporada del VRS con una dosis única. Debido a su tecnología de semivida prolongada, esta herramienta preventiva se está desarrollando como dosis única para todos los lactantes en su primera temporada de VRS. (5,6,14). Se trata de una inmunización desarrollada para ofrecer protección profiláctica directa frente al VRS a todos los lactantes a través de un anticuerpo administrado para ayudar a prevenir las ITRI causadas por el VRS. Los anticuerpos monoclonales no requieren la activación del sistema inmunitario para ofrecer una protección rápida y directa frente a la enfermedad. (15)
En marzo de 2017, Sanofi y AstraZeneca anunciaron un acuerdo para desarrollar y comercializar nirsevimab. En virtud de los términos del acuerdo, AstraZeneca dirige todas las actividades de desarrollo y fabricación y Sanofi dirigirá las actividades de comercialización y el registro de los ingresos. En virtud de los términos del acuerdo global, Sanofi realizó un pago inicial de 120 millones de EUR, ha pagado una etapa de desarrollo de 30 millones de EUR y pagará hasta 465 millones de EUR adicionales tras alcanzar determinadas etapas relacionados con el desarrollo y las ventas. Las dos empresas comparten todos los costes y beneficios. Los ingresos procedentes del acuerdo se notifican como ingresos de colaboración en los estados financieros de la compañía.
Nirsevimab ha recibido designaciones regulatorias para facilitar el desarrollo acelerado por cinco importantes agencias reguladoras de todo el mundo. Entre ellas, se incluyen la designación de Terapia Innovadora por el Centro para la Evaluación de Medicamentos de China bajo la Administración Nacional de Productos Médicos (NPMA); la designación de tratamiento innovador de la Administración de Alimentos y Medicamentos de EE. UU; el acceso otorgado al plan PRIority Medicines (PRIME) de la Agencia Europea de Medicamentos (EMA); la designación como Medicamento Innovador Prometedor por parte de la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA) y el nombramiento como “medicamento de desarrollo prioritario» en el marco del “Proyecto de selección de medicamentos para promover el desarrollo de nuevos medicamentos en pediatría” de la Agencia de Investigación y Desarrollo Médico de Japón (AMED). La seguridad y eficacia de nirsevimab está siendo evaluada actualmente bajo un procedimiento de evaluación acelerado por parte de la EMA. Nirsevimab no ha sido aprobado por ninguna autoridad reguladora.
El ensayo de fase 2b fue un ensayo aleatorizado y controlado con placebo diseñado para medir la eficacia de nirsevimab contra la IVR atendida médicamente hasta 150 días después de la dosis. Se asignaron al azar (2:1) bebés prematuros sanos de 29-35 semanas de gestación para recibir una única inyección intramuscular de 50 mg de nirsevimab o placebo. Entre noviembre de 2016 y diciembre de 2017, se aleatorizaron 1.453 lactantes (nirsevimab, n=969; placebo, n=484) al inicio de la temporada del VRS. La investigación fue realizada por AstraZeneca en ambos hemisferios, en 164 centros de 23 países.6 Los datos se publicaron en el New England Journal of Medicine (NEJM) en julio de 2020. El régimen de dosificación se optimizó basándose en la exploración adicional de estos datos. El estudio subsiguiente de fase 3 MELODY aplicó el régimen de dosificación optimizado. (1,5)
El ensayo MELODY, de fase 3, fue un ensayo aleatorizado y controlado con placebo realizado en 21 países y diseñado para determinar la eficacia de nirsevimab frente al ITRI debido al VRS confirmado por la prueba de reacción en cadena de la polimerasa de la transcriptasa inversa hasta 150 días después de la dosis, frente a placebo, en lactantes sanos prematuros tardíos y a término (35 semanas de edad gestacional o más) que se exponían a su primera temporada de VRS.5 Los lactantes fueron aleatorizados (2:1) para recibir una única inyección intramuscular de 50 mg (en lactantes que pesaban <5 kg) o 100 mg (en lactantes que pesaban ≥5 kg) de nirsevimab o placebo. Entre julio de 2019 y marzo de 2020, 1.490 lactantes fueron aleatorizados a nirsevimab o a placebo al inicio de la temporada del VRS (3). Los datos del análisis primario se publicaron en NEJM en marzo de 2022.
Los análisis agrupados preespecificados de los ensayos de la fase 3 y de la fase 2b examinaron a los lactantes que recibieron el régimen de dosificación optimizado (lactantes de menos de 5 kg en el momento de la dosificación y que recibieron la dosis de 50 mg de la fase 2b y los lactantes de la fase 3), y demostraron una eficacia del 79,5% (IC del 95%: 65,9 a 87,7; P<0,0001) frente las ITRI atendidas médicamente y del 77,3% (IC del 95%: 50,3 a 89,7; P<0,001) frente las hospitalizaciones a causa de ITRI por VRS. El análisis se basó en 2.350 lactantes, de los cuales 1.564 fueron asignados aleatoriamente a recibir nirsevimab y 786 a recibir placebo.(1)
Los resultados de MELODY, de MEDLEY fase 2/3 y los ensayos de fase 2b demuestran que nirsevimab proporciona protección frente al VRS en todos los lactantes que enfrentan su primera temporada de VRS con una sola dosis (1-5). Esta población de lactantes incluye prematuros, prematuros tardíos sanos y lactantes a término, así como con afecciones específicas. Estos ensayos constituyen la base de las presentaciones reglamentarias que comenzaron en 2022.
Referencias
1. Simões, E, et al. Pooled efficacy of nirsevimab against RSV lower respiratory tract infection in preterm and term infants. ESPID 2022 Congress; 2022 May 9-13. Hybrid Congress. Abstract
2. Wilkins, D, et al. Nirsevimab for the prevention of respiratory syncytial virus infection: neutralizing antibody levels following a single dose. ESPID 2022 Congress; 2022 May 9-13. Hybrid Congress. Abstract
3. Hammitt LL, MD et al. Nirsevimab for Prevention of RSV in Healthy Late -Preterm and Term Infants. N Engl J Med. 2022;386 (9): 837-846. doi: 10.1056/NEJMoa2110275.
4. Griffin P, MD et al. (2020). Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants. NEJM 2020; 383: 415-425. DOI: 10.1056/NEJMoa1913556.
5. Clinicaltrials.gov. A Study to Evaluate the Safety and Efficacy of MEDI8897 for the Prevention of Medically Attended RSV LRTI in Healthy Late Preterm and Term Infants (MELODY). https://clinicaltrials.gov/ct2/show/NCT03979313. Accessed April 2022.
6. Clinicaltrials.gov. A Study to Evaluate the Safety and Efficacy of MEDI8897 for the Prevention of Medically Attended RSV LRTI in Healthy Preterm Infants. (MEDI8897 Ph2b). https://clinicaltrials.gov/ct2/show/results/NCT02878330. Accessed April 2022.
7. Clinicaltrials.gov. A Study to Evaluate the Safety of MEDI8897 for the Prevention of Medically Attended Respiratory Syncytial Virus (RSV) Lower Respiratory Track Infection (LRTI) in High-risk Children. https://clinicaltrials.gov/ct2/show/NCT03959488. Accessed April 2022.
8. Simoes EA. Respiratory syncytial virus infection. Lancet. 1999 Sep 4;354(9181):847-52.
9. Flores-González JC, Mayordomo-Colunga J, Jordan I, Miras-Veiga A, Montero-Valladares C, Olmedilla-Jodar M, et al. Prospective Multicentre Study on the Epidemiology and Current Therapeutic Management of Severe Bronchiolitis in Spain. Biomed Res Int. 2017;2017:2565397.
10. Sociedad Española de Neumología Pediátrica [Internet]. Madrid: Sociedad Española de Neumología Pediátrica (SENP); 2018 [actualizado 23 de enero de 2022; citado 24 de enero de 2022]. Bronquiolitis. Disponible en: https://neumoped.org/bronquiolitis/
11. Pediatría Integral [Internet]. Madrid: Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP); 2012 [actualizado 2012; citado 24 de enero de 2022]. Bronquitis y bronquiolitis. Disponible en: https://www.pediatriaintegral.es/numeros-anteriores/publicacion-2012-01/bronquitis-y-bronquiolitis/
12. Martinón Torres F, Carmo M, Platero L, Drago G, López Belmonte JL, Ibanez C, Bangert M, Díez Domingo J. Hospital burden of acute lower respiratory infection due to respiratory syncityal virus in Spanish children,2015-2018.Poster presented at ESPID Congress. Athenas. Greece. May 2022.
13. Garcés Sánchez M, Martinón Torres F, Platero L, Drago G, López Belmonte JL, Díez Domingo J. Carga clínica y económica del virus respiratorio sincitial en el entorno ambulatorio. Rev Pediatr Aten Primaria Supl. 2022;(31):e83-e84
14. Zhu Q, et al. A highly potent extended half-life antibody as a potential RSV vaccine surrogate for all infants. Sci Transl Med. 2017;9:pii: eaaj1928
15. Centers for Disease Control and Prevention. Vaccines & Immunizations. August 18, 2017. https://www.cdc.gov/vaccines/vac-gen/immunity-types.htm. Accessed April 2022.